top of page


Teorías de ácidos y bases
Antes de iniciar observa el siguiente video...
Teoría de Arrhenius
El comportamientos de los ácidos y bases fue relacionado a finales del siglo XVII. Es así que en 1787 Lavoisier aseguró que el oxígeno es de vital importancia en la conformación de un ácido; y en 1810 Davy concluyó que el hidrógeno es el componente esencial de los ácidos. La naturaleza de los ácidos y bases fueron teorizadas por los siguientes científicos:
Presentó la teoría de la disociación iónica, esto fue en 1884. Se dijo que muchas sustancias en disolución acuosa experimentan una ruptura o disociación en iones positivos y negativos.
¿Cuál fue la conceptualización de Arrhenius para ácidos y bases?
ÁCIDO: Sustancia que en disolución acuosa se disocia con formación de iones de hidrógeno H+.
BASE: Sustancia que en disolución acuosa se disocia con formación de iones de hidroxilo OH-.

No olvides revisar las diapositivas y ver el video dando clic aquí o escaneando el código QR.
También debemos conocer la definición de electrolito
Teoría de Brønsted-Lowry
Según esta teoría propuesta por estos científicos...
Un ÁCIDO es toda especie química, molecular o iónica capaz de ceder un ion H+, es decir un protón a otra sustancia.
Una BASE es toda especie química, molecular o iónica, capaz de recibir un ion H+ de otra sustancia.


La reacción ácido-base consiste en la transferencia de un protón H+ desde un ácido o una base.
Mientras que una reacción neutralizada consiste en la transferencia de un protón de un ácido a una base para dar lugar al ácido conjugado de la base y a la base conjugada del ácido.


Escanea el siguiente código QR o da clic aquí para mejorar tu aprendizaje.
Ácidos y Bases de Lewis
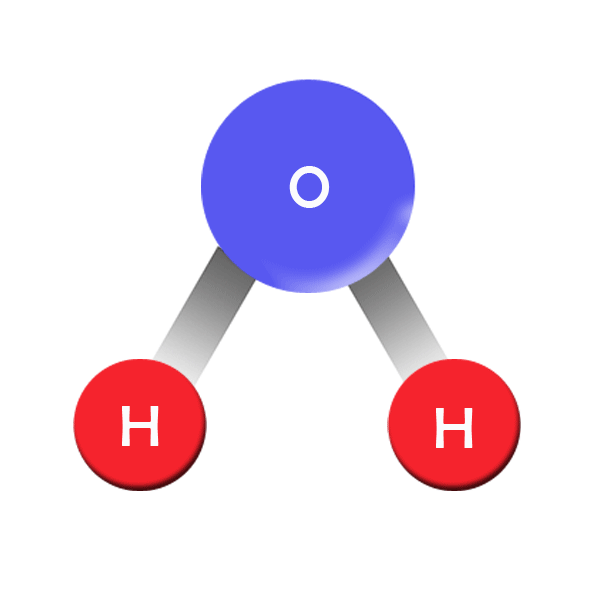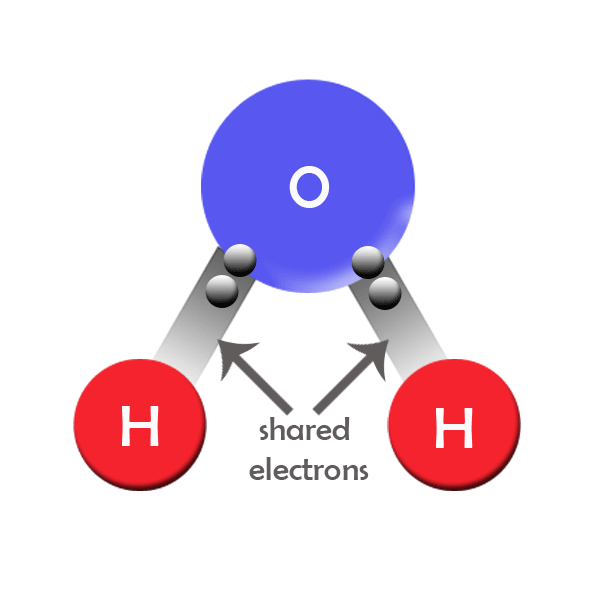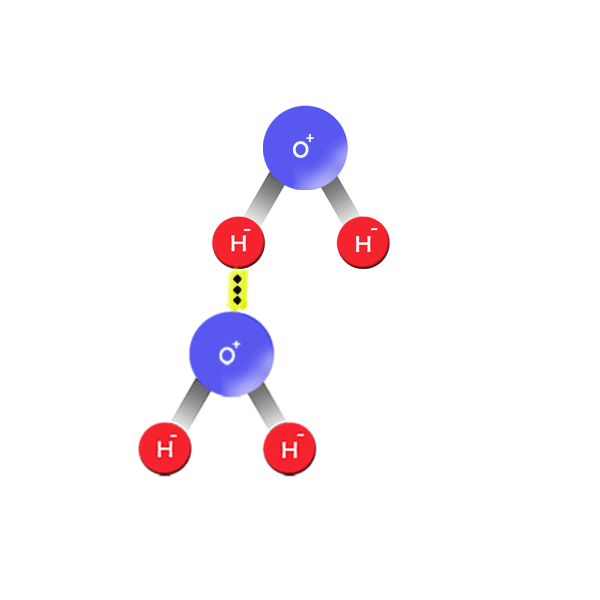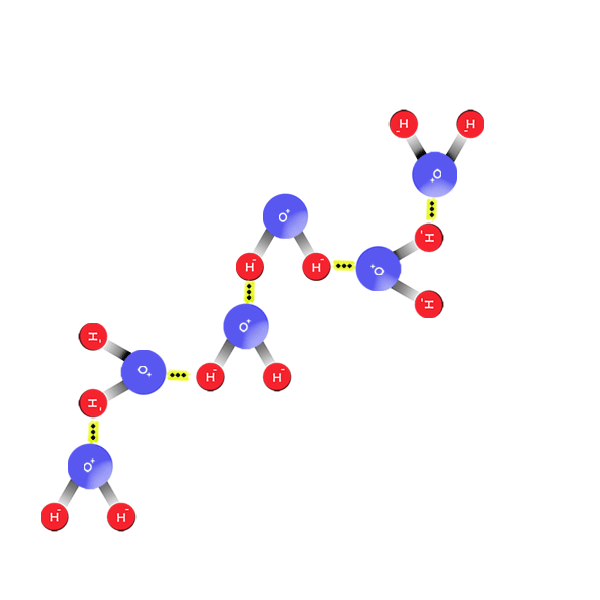
Se define a una base de Lewis como una sustancia capaz de donar electrones; mientras que, un ácido de Lewis es una sustancia capaz de aceptar electrones.
Un símbolo de la estructura de Lewis representa un punto por cada electrón de valencia de un elemento de la tabla periódica.
Recuerda* (El número de electrones de valencia es el mismo que el número del grupo en el que está el elemento de la tabla periódica)

¿Cómo representar las estructuras de Lewis?

Observa el siguiente video...
¿Cómo reconocer las bases de Lewis?
Puedes dar clic aquí o escanea el siguiente código QR.

bottom of page