


Fracción molar

La fracción molar no tiene unidades, porque representa la relación que existe entre componentes. Al componente A lo representamos en fracción molar como XA y lo definimos así:


La suma de las fracciones molares de una mezcla siempre da 1, por ejemplo, si hubiera dos componentes.

Ejercicio con su procedimiento
Un globo está compuesto por varios gases: 5 gramos de hidrógeno (H2 ), 60 gramos de nitrógeno molecular (N2 ) y 120 gramos de dióxido de carbono (CO2 ). Encontremos la fracción molar:
Paso 1:
Transformemos las unidades a moles.




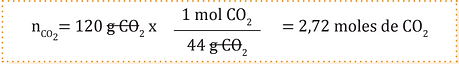
Paso 2:
Obtengamos las moles totales.

Paso 3:
Obtengamos las moles totales.




La manera de comprobar si el ejercicio está bien resuelto es sumando las fracciones molares. Recordemos que el resultado debe ser 1.




Resumen:
Porcentaje en masa: Masa de un componente, expresado en gramos, disuelta en 100 g de disolución.
Porcentaje en volumen: Unidades de volumen de un componente disuelto en 100 unidades de volumen de disolución.
Partes por millón (ppm): Miligramos de soluto por kilogramo de disolución.
Molaridad (M): Número de moles de un componente por litro de disolución.
Molalidad (m): Número de moles de un componente (generalmente el soluto) por kilogramo de disolvente.
Fracción molar: Cociente entre el número de moles de un componente y el número total de moles presentes en la disolución.

Refuerza tu conocimiento con el siguiente video


Resuelve los siguientes ejercicios

